普利制药2024年第8个美国ANDA!规格全覆盖!原料制剂一体化!造影剂钆特酸葡胺注射液获得FDA美国上市许可
海南普利制药股份有限公司(以下简称“普利制药”或“公司”)于近日收到美国食品药品监督管理局(以下简称“FDA”)签发的钆特酸葡胺注射液的上市许可,标志着普利制药具备在美国销售钆特酸葡胺注射液的资格。这是2024年普利制药获批的第8个ANDA,获批速度在国内企业中名列前茅。
钆特酸葡胺注射液是普利制药自碘帕醇注射液、钆布醇注射液之后,美国市场获批的第三个造影剂产品,表明普利制药在美国造影剂市场的销售范围得到拓宽,为公司在造影剂领域的进一步发展奠定了坚实的基础,预期将对公司未来发展产生积极影响。

五个规格全覆盖,满足美国GPO和医院终端采购需求
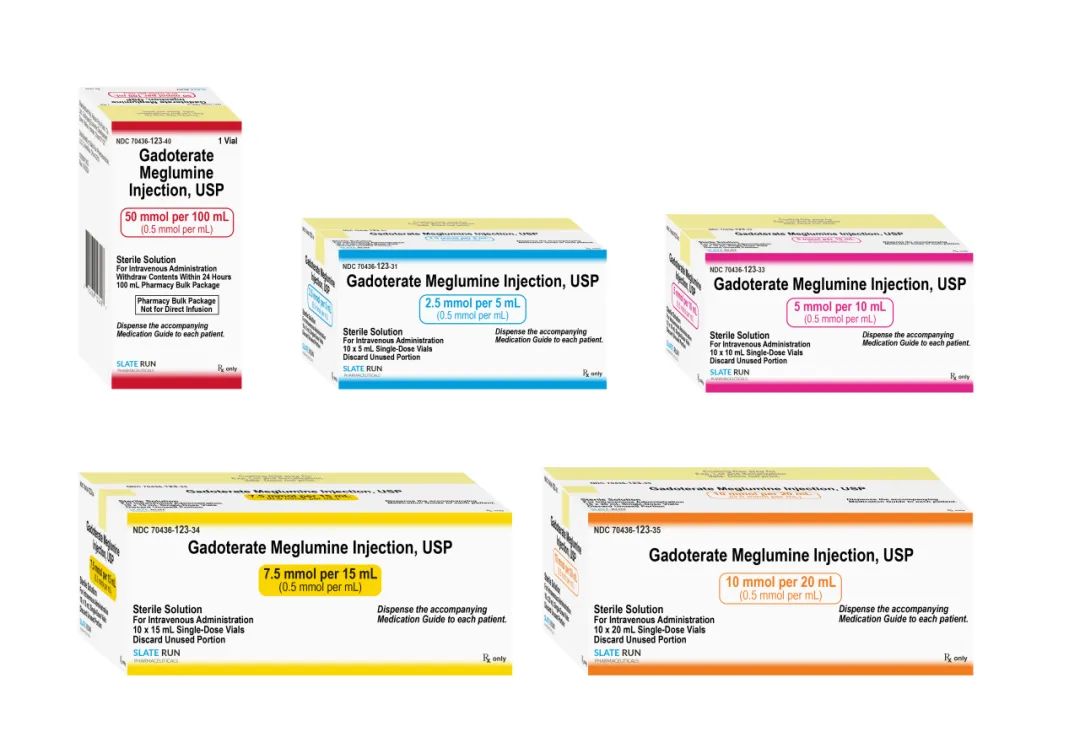
普利制药钆特酸葡胺注射液此次美国FDA获批的规格为全规格,分别为:1.8845g/5mL,3.769g/10mL,5.6535g/15mL,7.538g/20mL,37.69g/100mL共5个规格,与原研加柏(GUERBET)的规格一致,能全面满足临床不同患者核磁共振增强检查项目需要,实现精准给药。这是美国市场第四个获批的全规格钆特酸葡胺注射液。
疫情以前造影剂的销售通常跟设备绑定,仿制药进入较困难。但新冠疫情期间因造影剂的短缺,改变了GPO及医院终端的想法,供货稳定性成为首选,他们寻找仿制药来一起平衡市场,保证市场供货稳定,跟原研也不再签订独家协议,给我们带来了巨大的商机。
全品规且稳定供货是GPO及医院终端药品采购的必备条件。钆特酸葡胺注射液5个品规获美国FDA上市批准,规格全覆盖,满足美国GPO和医院终端采购需求。
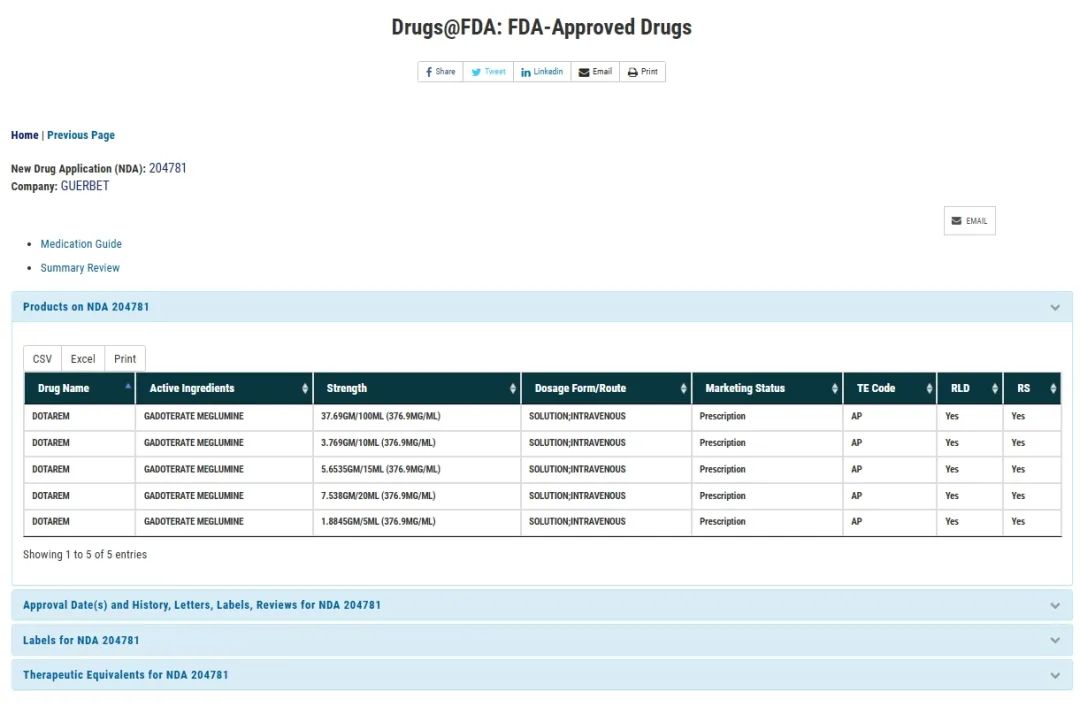
FDA官网:原研加柏获批5个规格
原料制剂一体化品种,为拓展美国市场提供坚实的保障
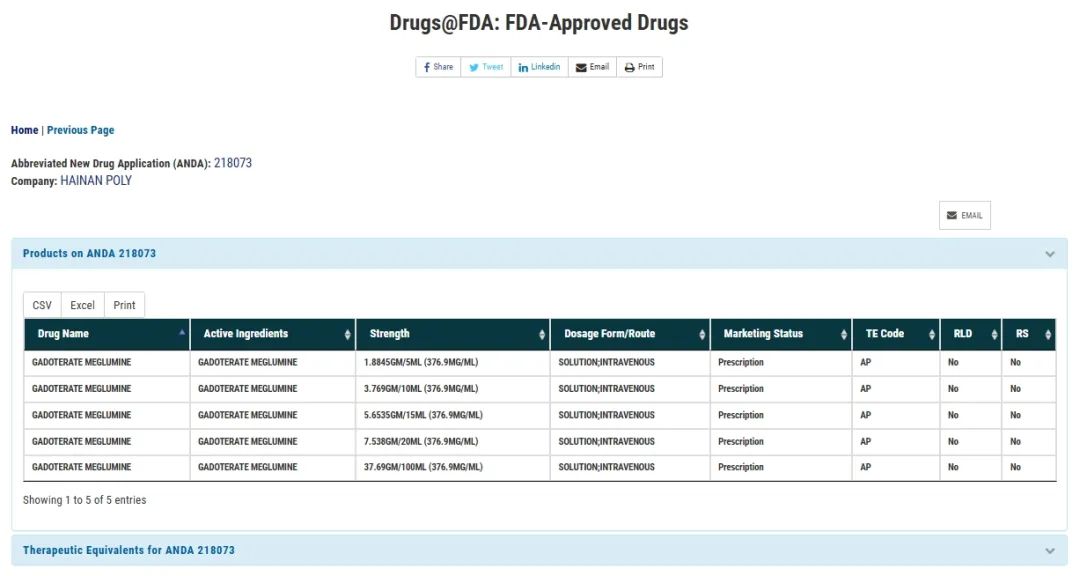
钆特酸葡胺注射液是普利制药在美国的第一款原料制剂双获批的原料制剂一体化造影剂,其原料来自海南普利制药股份有限公司子公司安徽普利药业有限公司。
安徽普利药业原料药车间于2023年通过FDA现场检查,今年5月,安徽普利药业钆特酸葡胺原料药DMF通过美国食品药品监督管理局技术审评,收到钆特酸葡胺(Gadoterate Meglumine)原料药First Adequate Letter(FAL)。US DMF号为037072。
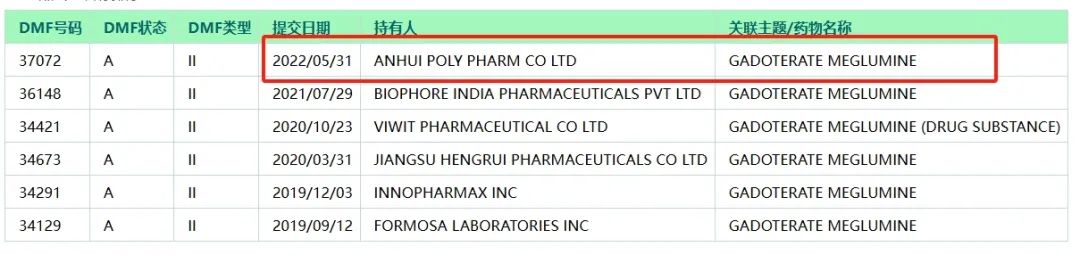
作为原料制剂一体化品种,普利制药的钆特酸葡胺注射液不会受制于原料药市场,可稳定保障临床供应,深受美国GPO欢迎,为公司持续拓展美国市场提供坚实的保障。
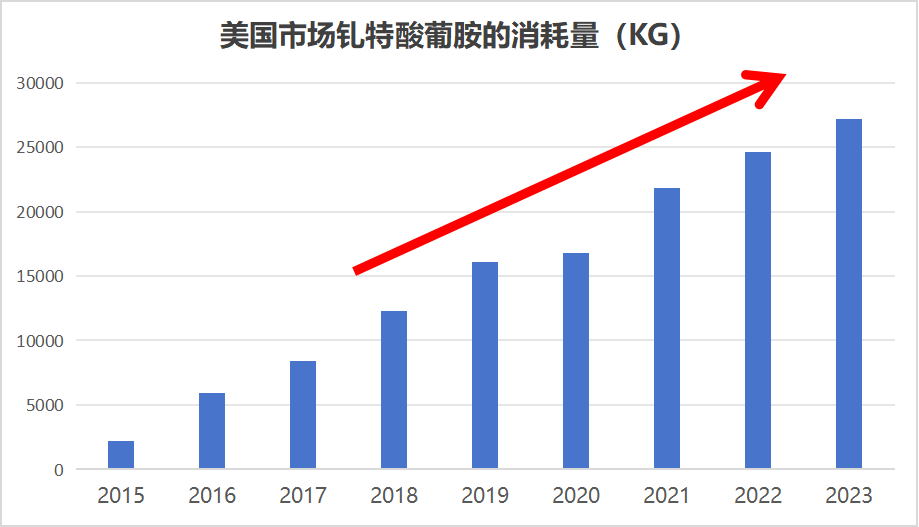
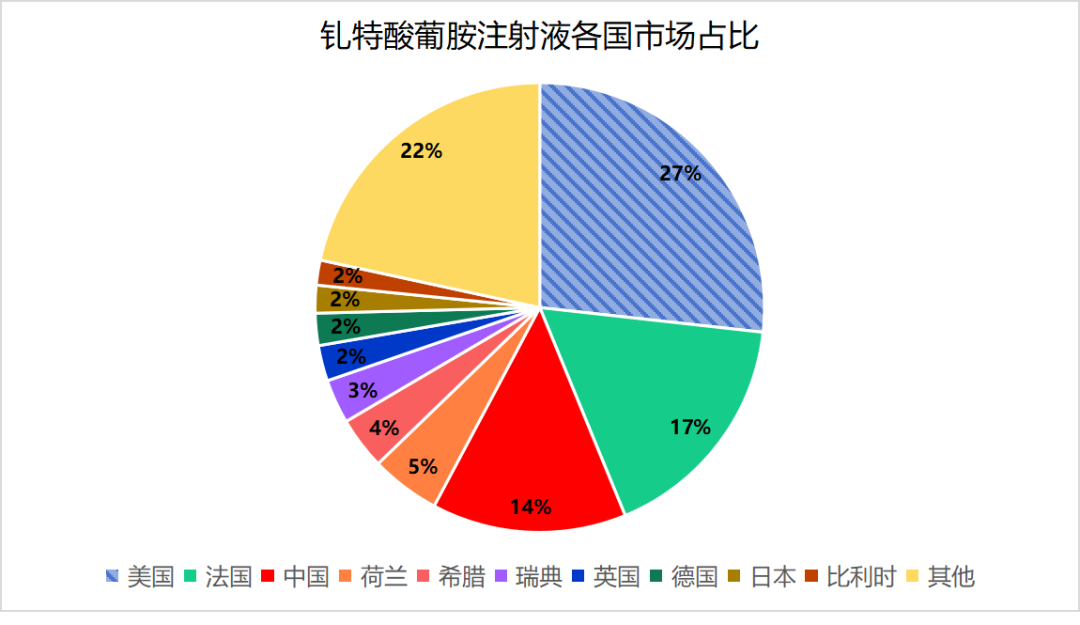
根据IMS市场的数据报告,钆特酸葡胺注射液在2023年全球市场的容量4.56亿美元。在全球市场中,美国市场容量1.22亿美元,占比27%,成为全球第一大市场。
而在中国市场,尽管其市场规模相较于美国较小,但仍然达到了全球第三的地位。
据IMS数据测算,近五年来,美国钆特酸葡胺注射液的消耗量复合增长率约为11%,呈现逐年递增的趋势。
我们有理由相信,随着科学技术的进一步发展和核磁共振仪的普适性增加,美国钆特酸葡胺注射液市场将继续保持增长态势。